Introducción
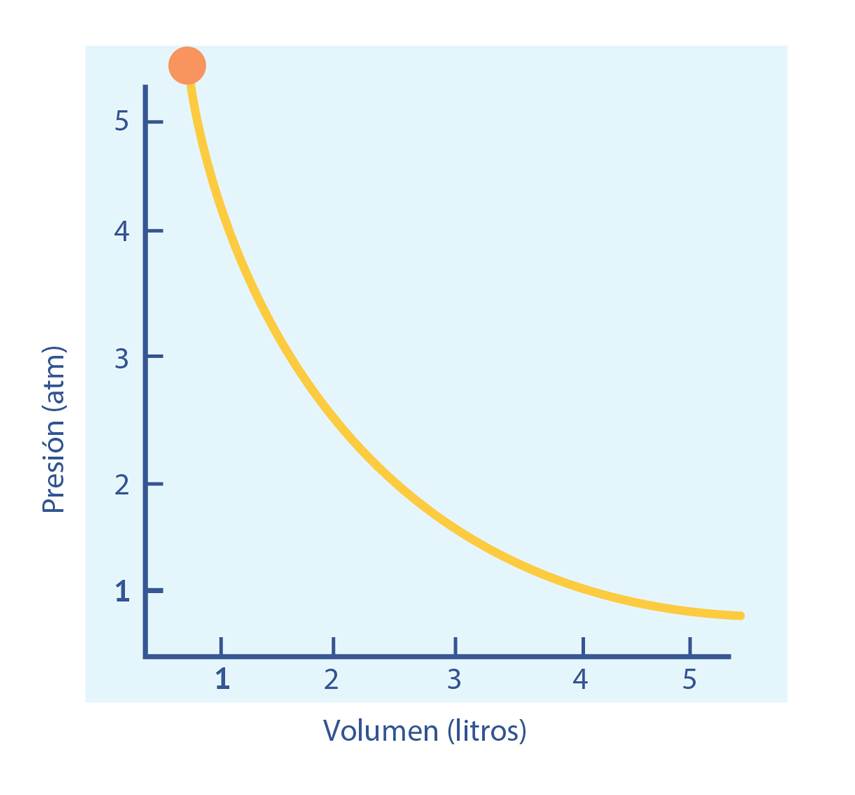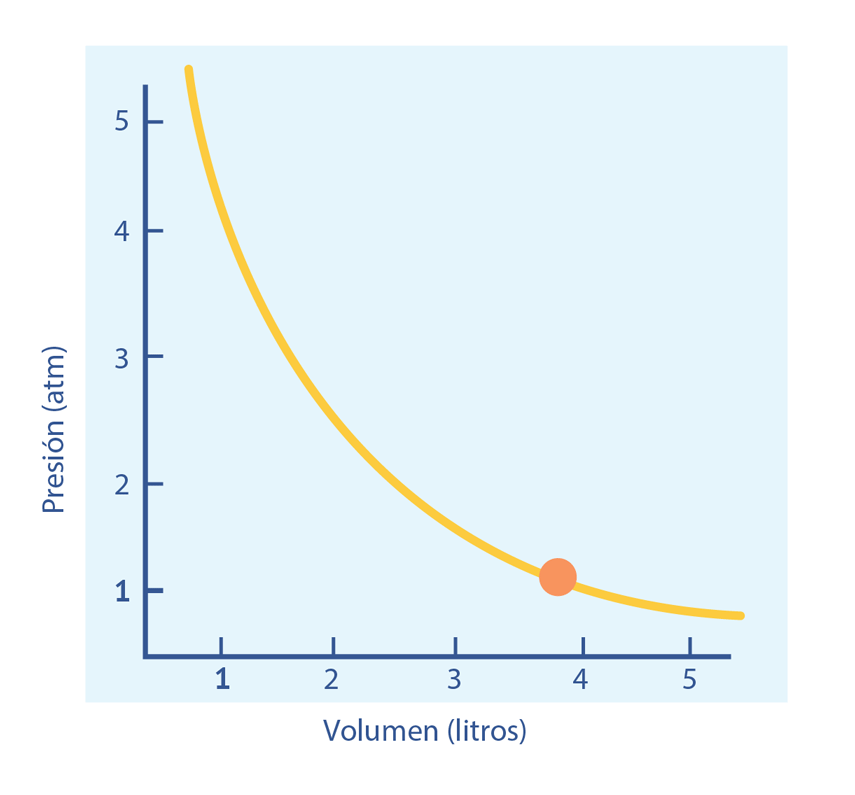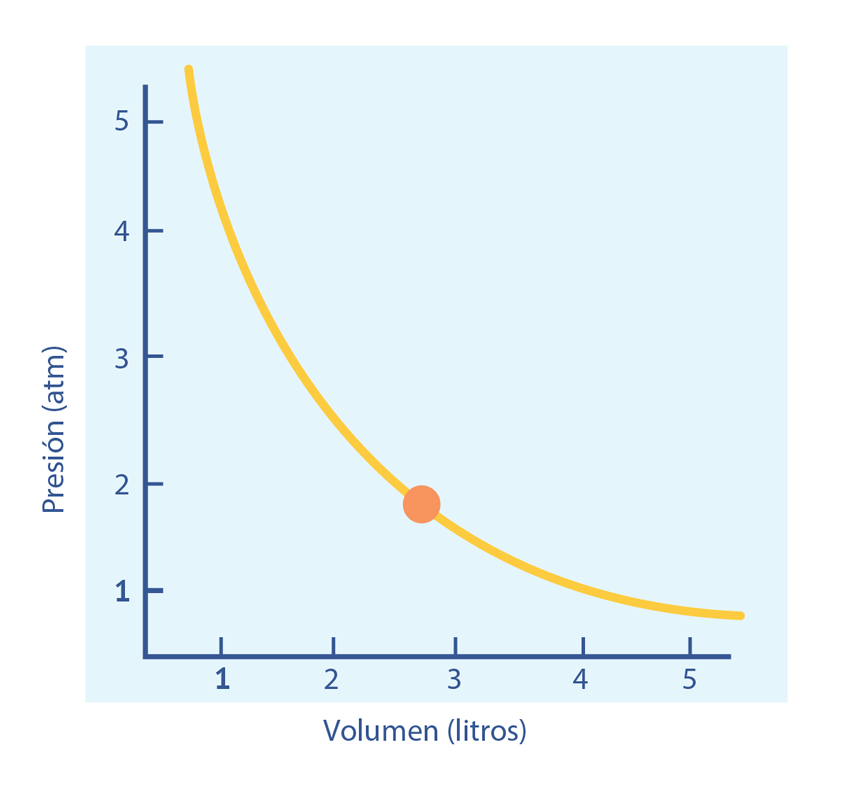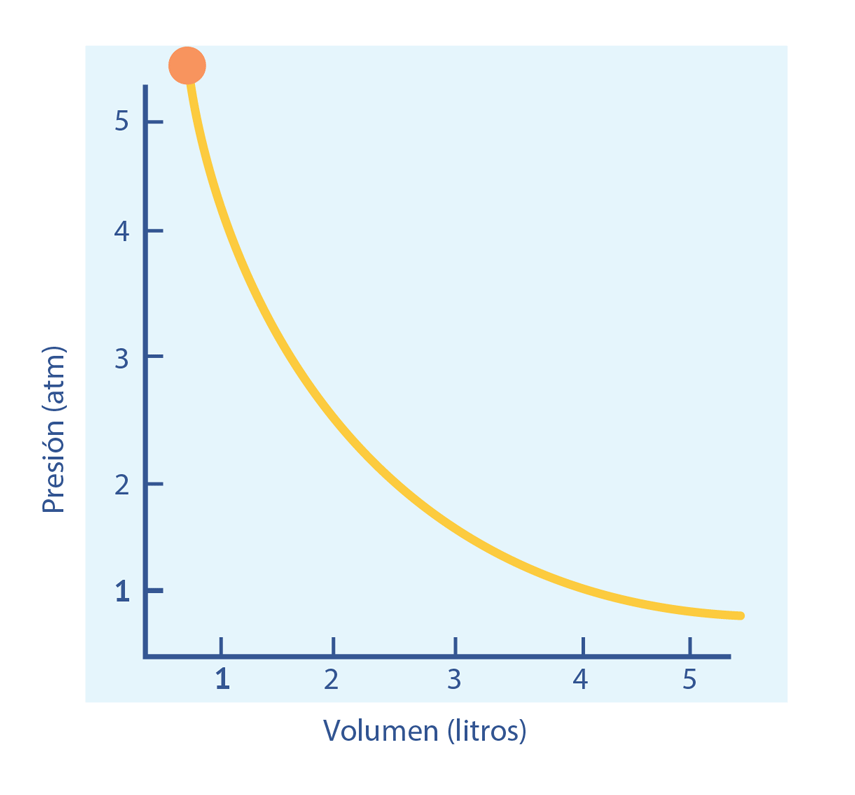
Las leyes empíricas se vinculan con las matemáticas, que describen las relaciones entre las variables de estado —presión, volumen, temperatura— en los gases; se denominan empíricas, debido a que son el resultado de observaciones y numerosos experimentos sobre distintos sistemas gaseosos.
En esta unidad, cuya duración es de una hora, revisarás una de éstas, la ley de Boyle, desde sus aspectos generales hasta el desarrollo que se sigue cuando esta ley requiere ser aplicada en problemas de impacto biológico; por ejemplo, en el proceso de inhalación, los pulmones se expanden, disminuyendo la presión de aire en su interior.
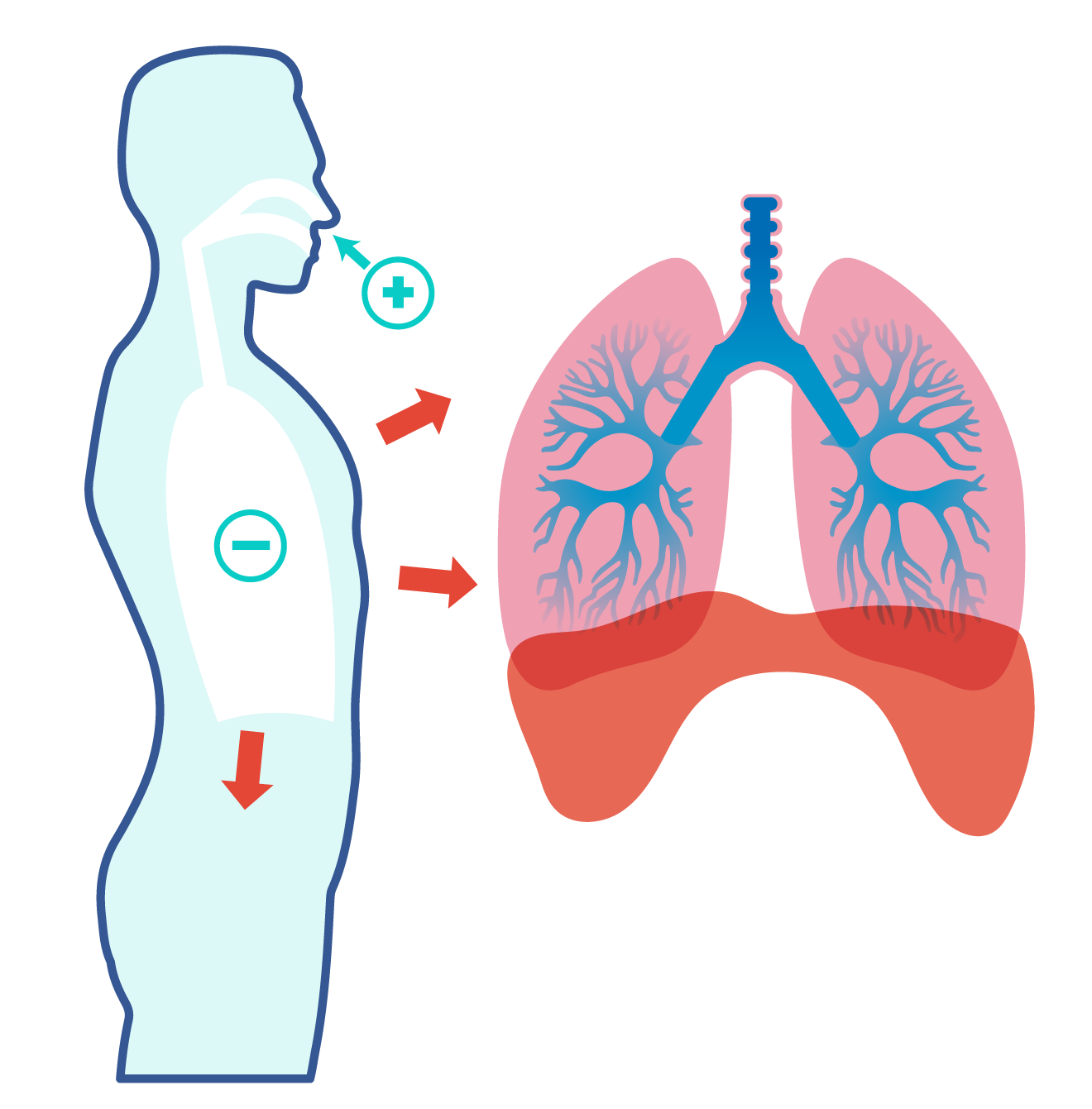
“Proceso de respiración”.
(s. a.) (s. f.). Proceso de respiración [imagen]. Tomada de https://upload.wikimedia.org/wikipedia/commons/thumb/8/8e/Inhalation_diagram.svg/572px-Inhalation_diagram.svg.png